病理组学+转录组学,简单模型也能发一区文章|文献速递·24-10-12
小罗碎碎念
本期推文的四篇文章,除了第一篇文章是21年发表的,其余的三篇文章均是24年发表的。选择第一篇文章的理由很简单,因为在这篇文章里介绍里如何具体的定义并计算三级淋巴结构。
第二篇文章很有意思,我今天的另一篇推文会详细分析这篇文章。这篇文章是在之前的一篇临床的文章基础上衍生的,所以两篇文章的作者团队都一样——来自复旦中山医院和中肿。
这篇文章没有自创一个复杂的模型,而是直接用cellprofiler来提取病理图像的特征,但是有意思的是他们把转录组学的数据结合进来了,最终发表在BMC Medicine,目前IF=7,1区。
第三、四篇有一个共同的特点——都使用了qupath,并且第四篇文章直接就是用qupath自带的分析功能去完成的分析。
一、深度学习在肺癌三级淋巴结构评估中的应用

一作&通讯
| 作者角色 | 姓名 | 单位名称 | 单位翻译 |
|---|---|---|---|
| 第一作者 | Panagiotis Barmpoutis | Department of Pathology, UCL Cancer Institute, University College London | 伦敦大学学院癌症研究所病理学系 |
| 通讯作者 | Francois Ng Kee Kwong | Department of Histopathology, Norfolk and Norwich University Hospital | 诺福克和诺维奇大学医院病理科 |
文献概述
这篇文章是关于在肺癌组织中识别和评估三级淋巴结构(Tertiary Lymphoid Structures, TLS)的研究。
TLS是炎症、感染或肿瘤组织中异位的淋巴细胞聚集体,它们在H&E染色的组织切片中可以被识别为独立实体。TLS的存在与癌症预后的改善相关,但目前尚无标准化方法来量化它们的存在。以往的研究使用免疫组织化学来确定特定细胞的存在作为TLS的标记,但这种方法被证明低估了TLS的真实数量。
本研究提出了一种基于H&E染色切片的TLS自动识别和量化方法。研究者使用深度卷积神经网络来识别TLS区域,并通过椭圆形模型来分割淋巴细胞。这种方法在特异性和敏感性方面表现出高准确性,能够以92.87%的特异性在95%的敏感性下,88.79%的特异性在98%的敏感性下,以及84.32%的特异性在99%的敏感性下识别TLS。
研究表明,TLS中淋巴细胞的最小数量是45个,最小TLS面积是6,245μm²。此外,TLS区域的淋巴细胞密度是TLS外区域的三倍以上。
文章还讨论了TLS在癌症治疗中的重要性,尤其是在肺癌、肾癌和皮肤癌的治疗中。
TLS在癌症中的高密度通常与患者的积极预后、结果和对免疫疗法的改善反应相关。研究还提到了TLS在肺癌中的三个成熟阶段,这些阶段与患者生存率密切相关。
研究者还比较了他们的方法与其他最先进的方法,包括SegNet、U-Net和基于淋巴细胞密度的阈值方法,并发现他们的方法在识别TLS区域方面更为准确。
此外,研究还提出了定义TLS的正式数学标准,包括TLS中淋巴细胞的数量、TLS的最小面积以及单位面积内淋巴细胞的密度。
最后,文章指出了研究的局限性,包括样本数量有限,无法将TLS密度与患者结果相关联,以及该方法尚未在其他癌症类型或不同中心的材料中得到验证。尽管如此,研究者认为他们的方法是未来研究的坚实基础,并可能在常规组织病理学实践中得到广泛应用。
简要分析
Fig 1 展示了研究中提出的三级淋巴结构(TLS)检测方法的流程,具体步骤如下:
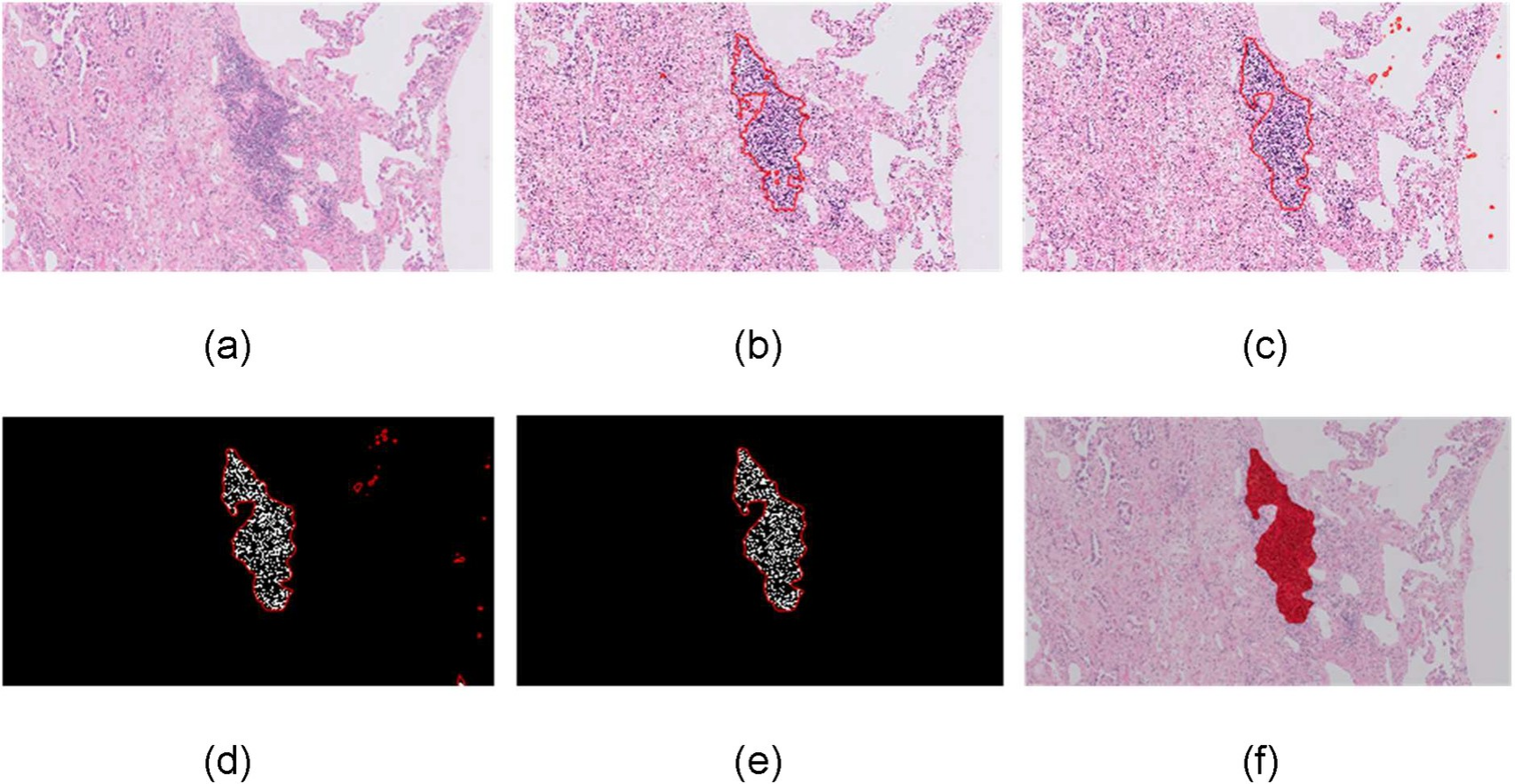
a) H&E图像输入DeepLab v3+网络:首先,将苏木精-伊红(H&E)染色的组织切片图像输入到一个改进的DeepLab v3+网络。这个网络是一个深度学习模型,用于语义图像分割任务,能够识别图像中的不同区域和结构。
b) 识别候选TLS区域:DeepLab v3+网络处理后,识别出可能是TLS的候选区域。这些区域是基于网络学习到的特征被认为与TLS相关的图像区域。
c) 应用活跃轮廓模型细化TLS边界:为了更精确地确定TLS的边界,研究者采用了活跃轮廓(active contour)方法,这是一种图像处理技术,用于从图像数据中提取目标的轮廓。这一步骤有助于改善TLS区域的边界定义。
d) 进行淋巴细胞分割:在确定了TLS的候选区域之后,接下来进行淋巴细胞的分割。这是通过一个椭圆形模型来实现的,该模型能够区分和计算TLS区域内的单个淋巴细胞。
e) 通过排除非TLS候选区域来验证TLS:在淋巴细胞分割之后,需要对候选的TLS区域进行验证,以排除那些不是TLS的区域。这通常涉及到一些后处理步骤,例如使用支持向量机(SVM)分类器,来确定一个区域是否真的是TLS。
f) 最终检测TLS区域:经过上述步骤后,最终确定的TLS区域被标记出来,这些区域代表了在肺癌组织切片中成功识别的三级淋巴结构。
整个流程结合了深度学习、图像处理和机器学习技术,自动化了TLS的识别和量化过程,这对于病理学研究和癌症预后评估具有重要意义。通过这种方法,研究者能够以高准确性评估TLS的密度,进而可能为癌症治疗和免疫反应的研究提供重要信息。
二、深度学习在肝内胆管癌病理图像中的预后特征挖掘

一作&通讯
| 作者类型 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Guang-Yu Ding | 复旦大学中山医院肝外科和移植中心,教育部肝癌研究所,中山医院,上海,中国 |
| 通讯作者 | Mu-Yan Cai | 中山大学附属肿瘤医院国家癌症中心南方肿瘤学重点实验室,广州,中国 |
| 通讯作者 | Bo Yan | 复旦大学中山医院病理学系,上海,中国 |
| 通讯作者 | Qiang Gao | 复旦大学中山医院肝外科和移植中心,教育部肝癌研究所,中山医院,上海,中国 |
文献概述
这篇文章是关于使用多模态深度学习从肝内胆管癌(iCCA)的病理图像中挖掘可解释的预后特征的研究。
研究团队建立了一个综合预后神经网络,用于全面评估全切片图像中的结构和细粒度信息。通过多模态数据,他们对模型进行了广泛的询问,以提取和可视化与临床结果和潜在分子变化最相关的形态学特征。
研究结果表明,模型在内部(n=213)和外部(n=168)队列上都表现出一致的准确性和鲁棒性。通过遮挡敏感性图揭示了影响预后的关键结构特征,包括三级淋巴结构的分布、侵袭边缘的几何特征、肿瘤实质和基质的相对组成、坏死程度、播散灶的存在以及肿瘤邻近微血管。
通过CellProfiler提取的可量化形态学向量表明,高风险患者的肿瘤核表现出显著更大的大小、更扭曲的形状、核膜和纹理对比度更不明显。多组学数据进一步揭示了关键分子变化留下形态学印记,这些变化可以被网络识别,包括糖酵解、缺氧、顶端连接、mTORC1信号和免疫浸润。
研究结论是,他们提出了一个可解释的深度学习框架,以洞察iCCA的生物学行为。网络感知的大多数显著形态学预后指标对人类思维是可理解的。该研究可能对癌症预后模型的开发和临床应用具有重要意义。
简要分析
Fig. 1 展示了分类网络和全局分割图(GSM)的构建和结果,具体内容如下:
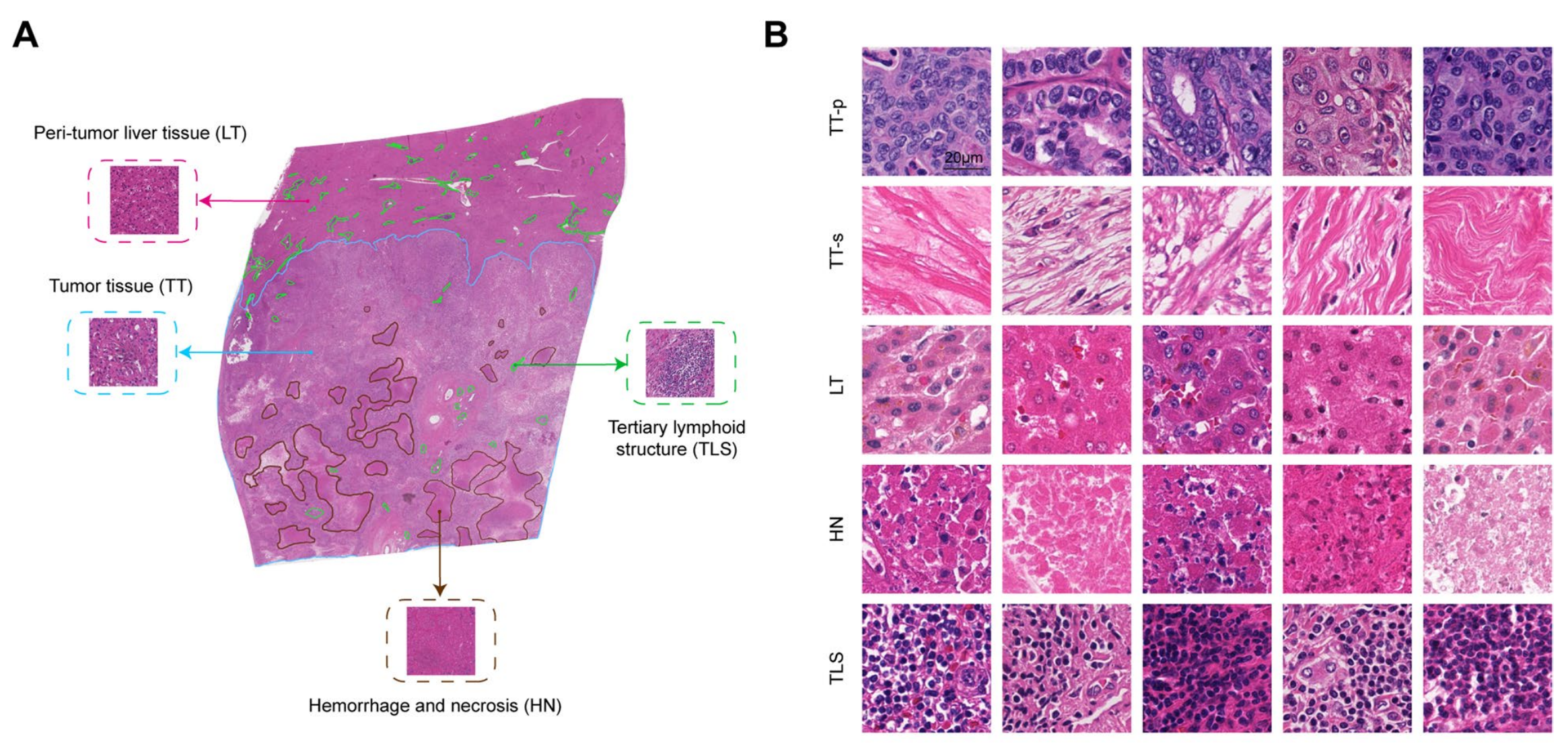
A. 标注的全切片图像(WSI)的表示:展示了病理学家如何对全切片图像进行手动标注,以区分不同的组织区域。
B. 用于训练分类网络的标注瓦片的表示:说明了如何将标注的全切片图像分割成小块(256×256像素),称为标注瓦片,用于训练分类网络。
WSI:全切片图像,LT:肿瘤周围肝组织,TT:肿瘤组织,TT-p:肿瘤实质,TT-s:肿瘤基质,TLS:三级淋巴结构,HN:出血和坏死区域。这些术语用于描述图像中的不同组织类型,以便于在病理分析和模型训练中进行识别和区分。
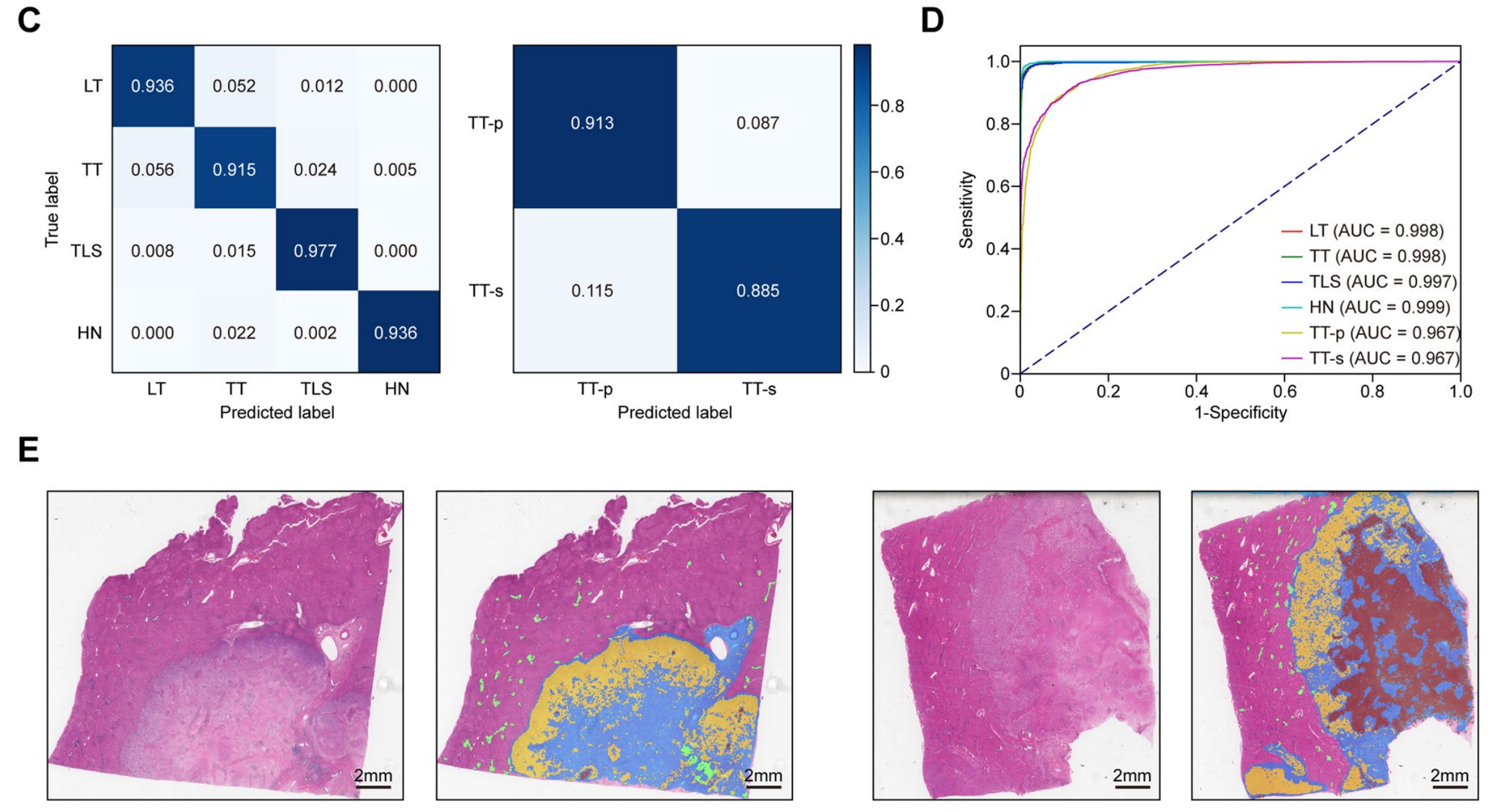
C. 分类结果的归一化混淆矩阵:通过混淆矩阵展示了分类网络的性能,包括每个类别的识别准确率和混淆情况,归一化处理使得可以跨类别比较性能。
D. 分类网络每个组织类别的曲线下面积(AUC):AUC是评估分类模型性能的指标,值越接近1表示模型的区分能力越强。这里展示了每个组织类别的AUC,反映了模型对不同组织类别的识别能力。
E. 两个由类别激活的全局分割图(GSM)的示例:展示了分类网络对全切片图像进行分割的结果,其中肿瘤实质(TT-p)用黄色标记,肿瘤基质(TT-s)用蓝色标记,出血和坏死区域(HN)用棕色标记,三级淋巴结构(TLS)用绿色高亮显示。这些颜色编码有助于直观地理解模型如何区分不同的组织结构。
关键问题
文章通过深度学习模型分析了三级淋巴结构(Tertiary Lymphoid Structures, TLS)在肝内胆管癌(iCCA)病理图像中的分布和密度,并探讨了它们与临床结果的关系。
具体的分析方法包括以下几个步骤:
-
图像预处理和标注:首先,研究者对病理图像进行预处理,去除无意义的背景,并由资深病理学家手动标注出不同的解剖子区域,包括TLS。
-
全局分割图(GSM)生成:使用分类网络对全切片图像(WSI)进行分析,生成全局分割图,其中TLS被特别标记和着色。
-
遮挡敏感性图(OSM):通过计算在GSM中遮挡TLS区域导致的的风险评分变化,生成了粗略的敏感性热图。在热图中,不同的颜色表示了高风险和低风险区域。
-
形态学特征提取:研究者使用CellProfiler软件从高风险和低风险的瓦片中自动提取了量化的图像向量,包括肿瘤细胞核的面积、形状、强度和纹理等特征。
-
多组学数据分析:研究者利用多组学数据(包括转录组学、蛋白质组学和RNA测序数据)进一步分析了TLS与分子变化之间的关系。
-
统计分析:通过统计测试,如卡方检验、Mann-Whitney U检验等,比较了TLS的分布和密度与患者临床病理特征之间的关系。
-
生存分析:研究者还进行了生存分析,以评估TLS特征与患者预后之间的关联。
文章的分析结果显示,TLS在肿瘤内部和周围的分布与患者的预后有显著关联。肿瘤内部的TLS(tTLS)与较好的预后相关,而肿瘤周围的TLS(pTLS)与较差的预后相关。这些发现表明,通过深度学习模型分析TLS的分布和密度可以为iCCA患者的预后提供有价值的信息。
三、HookNet-TLS模型在肿瘤免疫微环境中的三级淋巴结构分析

一作&通讯
| 作者角色 | 姓名 | 单位名称 |
|---|---|---|
| 第一作者 | Mart van Rijthoven | 荷兰拉德堡德大学医学中心病理学系 |
| 通讯作者 | Karina Silina | 瑞士苏黎世大学实验免疫学研究所;瑞士联邦理工学院药物科学研究所 |
| 通讯作者 | Francesco Ciompi | 荷兰拉德堡德大学医学中心病理学系 |
文献概述
这篇文章介绍了一种基于多分辨率深度学习模型HookNet-TLS的方法,用于自动识别和量化实体瘤中的三级淋巴结构(TLS)和生发中心(GC)。
TLS是外周组织中淋巴细胞的密集积累,与多种实体瘤的改善生存和对免疫疗法的反应相关。然而,由于缺乏标准化的TLS特征描述方法,不同患者、疾病和临床中心之间评估TLS密度存在困难。
研究者们开发了HookNet-TLS,这是一个自动化和无偏见的TLS量化方法,它使用常规的苏木精-伊红(H&E)染色数字病理幻灯片。**该模型使用来自肾透明细胞癌、肌浸润性膀胱癌和肺鳞状细胞癌的1019张手动注释的TCGA幻灯片进行开发。**研究结果表明,HookNet-TLS能够自动化TLS量化,并且在多种癌症类型中实现了人类水平的性能,显示出与视觉评估相似的预后关联。
HookNet-TLS的架构包括两个编码器-解码器U-Net分支,分别称为上下文分支和目标分支,它通过结合高分辨率细节和低分辨率的上下文信息来提高分割输出的准确性。该模型在训练时使用了来自TCGA的数据集,并在独立的验证和测试集上进行了评估。
此外,研究者们还比较了HookNet-TLS与Faster R-CNN(一种用于计算机视觉应用的对象检测方法)的性能,并验证了HookNet-TLS在预测TLS和GC方面的优越性。
研究还探讨了HookNet-TLS预测的TLS和GC的形态特征,并使用UMAP降维分析和PhenoGraph算法对这些特征进行了无监督聚类。
此外,研究还评估了TLS和GC密度与患者总体生存率的关系,并发现HookNet-TLS预测的TLS密度与手动注释的TLS密度在LUSC和KIRC肿瘤类型中显示出相似的预后相关性,而在BLCA中则需要更大的样本量来可靠评估。
最后,作者提供了HookNet-TLS的开源代码,并提供了一个公开可用的基于网络的工具,以促进该模型在临床决策和TLS在癌症中作用研究中的进一步开发和使用。
简要分析
Fig. 1 展示了HookNet-TLS模型的数据和处理流程,具体内容如下:
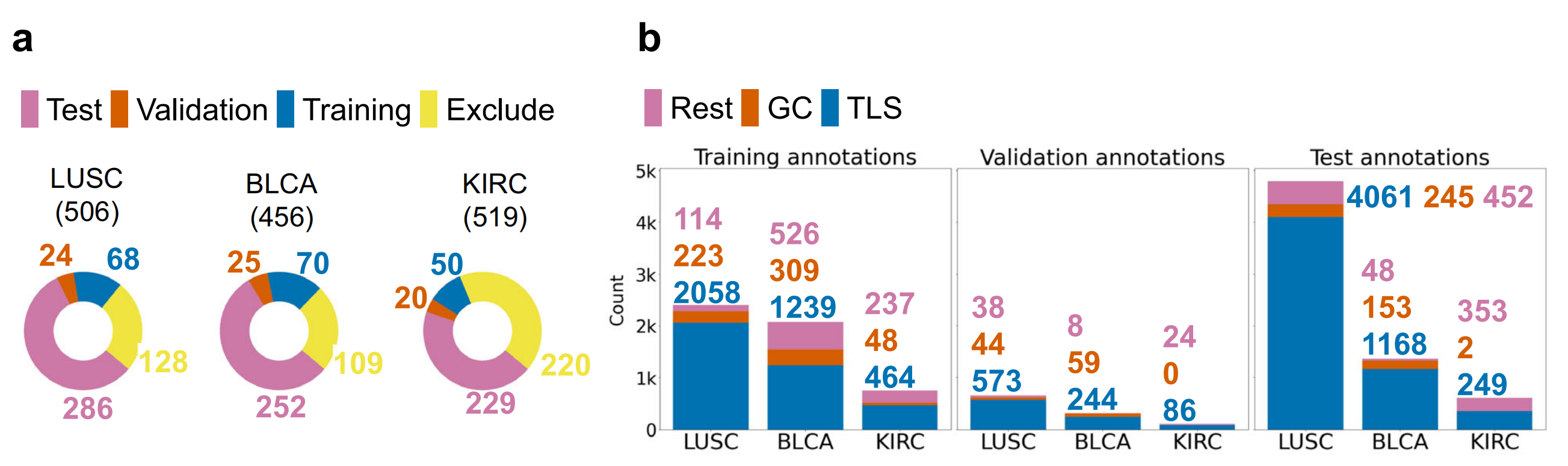
a. 该图说明了从癌症基因组图谱(TCGA)中获取的肌肉浸润性膀胱癌(BLCA)、肾透明细胞癌(KIRC)和肺鳞状细胞癌(LUSC)的诊断幻灯片,除去那些缺乏邻近正常组织或扫描质量差的幻灯片,剩余的被分为三个独立的数据集,分别用于模型的训练、验证和测试。
b. 该部分展示了每个数据集中不同类别的注释数量。所有选定的图像都对三级淋巴结构(TLSs)、生发中心(GCs)和淋巴结进行了详尽的注释,而对其他各种组织(Rest)的注释则较为稀疏,这些组织包括未组织的浸润物(炎症)、基质、肿瘤和各种实质区域。
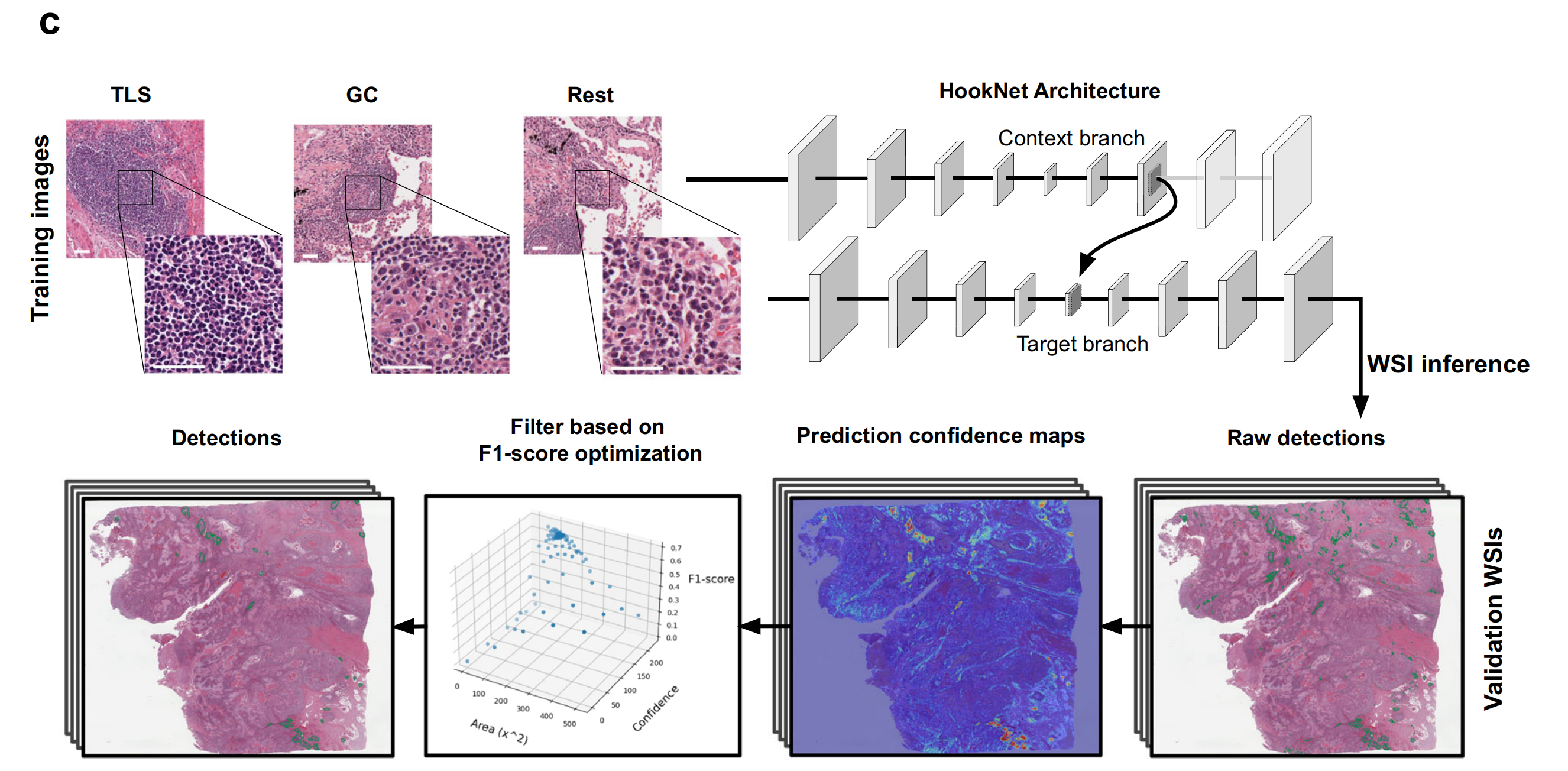
c. 该部分提供了HookNet-TLS模型架构的示意图,包括使用训练数据集进行的多分辨率基于补丁的训练,以及使用验证数据集进行的包括整个幻灯片图像推断和对象检测优化在内的后处理步骤(更多细节见方法部分)。比例尺 = 50 微米。
总的来说,Fig. 1 描述了HookNet-TLS模型如何使用来自TCGA的数据集进行训练和验证,并通过多分辨率方法来提高对TLSs和GCs的检测精度。这个过程涉及到大量的图像注释工作,以及后续的模型优化,以确保在实际应用中能够准确地识别和量化三级淋巴结构。
关键问题
文章是如何分析TLS的?
- 数据准备和预处理:
- 从癌症基因组图谱(TCGA)获取了肌肉浸润性膀胱癌(BLCA)、肾透明细胞癌(KIRC)和肺鳞状细胞癌(LUSC)的诊断幻灯片。
- 对幻灯片进行了质量控制,排除了缺乏邻近正常组织或扫描质量差的样本。
- 将剩余的幻灯片分为三个独立的数据集,分别用于模型的训练、验证和测试。
- 详尽的注释:
- 使用QuPath软件对选定的图像进行了详尽的注释,包括TLS、生发中心(GCs)和淋巴结的边界。
- 对其他各种组织(如未组织的浸润物、基质、肿瘤和各种实质区域)进行了稀疏注释。
- 模型开发:
- 开发了HookNet-TLS模型,这是一个基于深度学习的多分辨率模型,用于自动量化和识别TLS和GC。
- 模型包括两个编码器-解码器U-Net分支(上下文分支和目标分支),以结合高分辨率细节和低分辨率的上下文信息。
- 模型训练和验证:
- 使用来自TCGA的训练数据集对HookNet-TLS进行训练,以预测TLS、GC和其他组织(Rest)的分割目标类别。
- 使用独立的验证数据集对模型进行验证,并调整后处理参数。
- 后处理:
- 对模型生成的预测概率值进行阈值处理,以确定真正的阳性预测对象。
- 使用F1分数作为优化指标,在验证数据集上进行二维搜索,以找到最佳阈值。
- 模型评估:
- 使用F1分数来评估模型在独立测试数据集上的性能。
- 比较了HookNet-TLS与Faster R-CNN(一种先进的对象检测方法)的性能。
- 特征提取和分析:
- 从模型的最低编码层提取了每个区域的编码特征,并使用UMAP降维分析和PhenoGraph算法进行无监督聚类。
- 生存分析:
- 分析了与TCGA队列相关的临床信息,并评估了TLS密度与患者总体生存率之间的关系。
通过这些步骤,文章展示了HookNet-TLS模型在自动识别和量化TLS方面的性能,并评估了其在不同类型肿瘤中的预后相关性。
四、探索肺癌脑转移中的免疫微环境:三级淋巴结构的重要作用

一作&通讯
| 角色 | 姓名 | 单位名称(中文) | 单位名称(英文) |
|---|---|---|---|
| 第一作者 | SHOTA NOHIRA | 名古屋大学医学院神经外科 | Department of Neurosurgery, Nagoya University Faculty of Medicine |
| 通讯作者 1 | MASASUKE OHNO | 名古屋医疗中心神经外科 | Department of Neurosurgery, Nagoya Medical Center |
| 通讯作者 2 | MITSUGU FUJITA | 近畿大学医学院医学教育与临床培训中心 | Center for Medical Education and Clinical Training, Kindai University Faculty of Medicine |
文献概述
这篇文章是关于肺癌脑转移(BMs)中三级淋巴结构(TLSs)的研究。研究的背景是肺癌患者发生脑转移后预后较差(尽管治疗方法有所进步)。文章探讨了TLSs在脑转移肿瘤免疫微环境中的作用,这是一个尚未被广泛研究的领域。
研究方法:
- 研究使用了17名经过组织学确认的肺癌脑转移患者的临床样本,这些患者都接受了外科切除手术。
- 通过免疫组化分析脑转移组织中TLS和肿瘤浸润性淋巴细胞(TILs)的存在和特征,并与临床结果相关联。
主要发现:
- 在脑转移组织中发现了TLSs,尽管它们处于未成熟状态,与原发性肺癌组织中的成熟TLSs不同。
- TLS密度(而非TIL密度)与改善的术后生存有显著相关性,表明TLS密度可能是一个独立的预后标志物。
- TLS密度与分级预后评估(GPA)指数无相关性,表明它具有超越传统预测因素的独特预后价值。
结论:
- 研究揭示了TLSs在肺癌衍生的脑转移中的存在,并强调了它们独立的预后意义,不受GPA指数影响。
- 在独特的中枢神经系统肿瘤微环境中识别TLS为理解脑转移的免疫景观提供了新见解,并为针对这些结构的免疫治疗干预提供了潜在途径,以改善患者预后。
文章还讨论了TLSs在非淋巴组织中的形成,它们在塑造肿瘤免疫微环境(TIME)和促进抗肿瘤免疫中的关键作用。研究还提到了中枢神经系统(CNS)传统上被认为是免疫特权部位,但最近的证据表明它具有内在的免疫监视机制。
研究的局限性包括样本量小和单中心回顾性研究的性质,需要更大规模的前瞻性多中心研究来验证TLS密度与脑转移患者临床结果之间的关系。
简要分析
Figure 1 展示了肺癌原发性肿瘤和脑转移(BMs)中三级淋巴结构(TLSs)的组织病理学图像,并比较了两者中TLSs和肿瘤浸润性淋巴细胞(TILs)的密度。
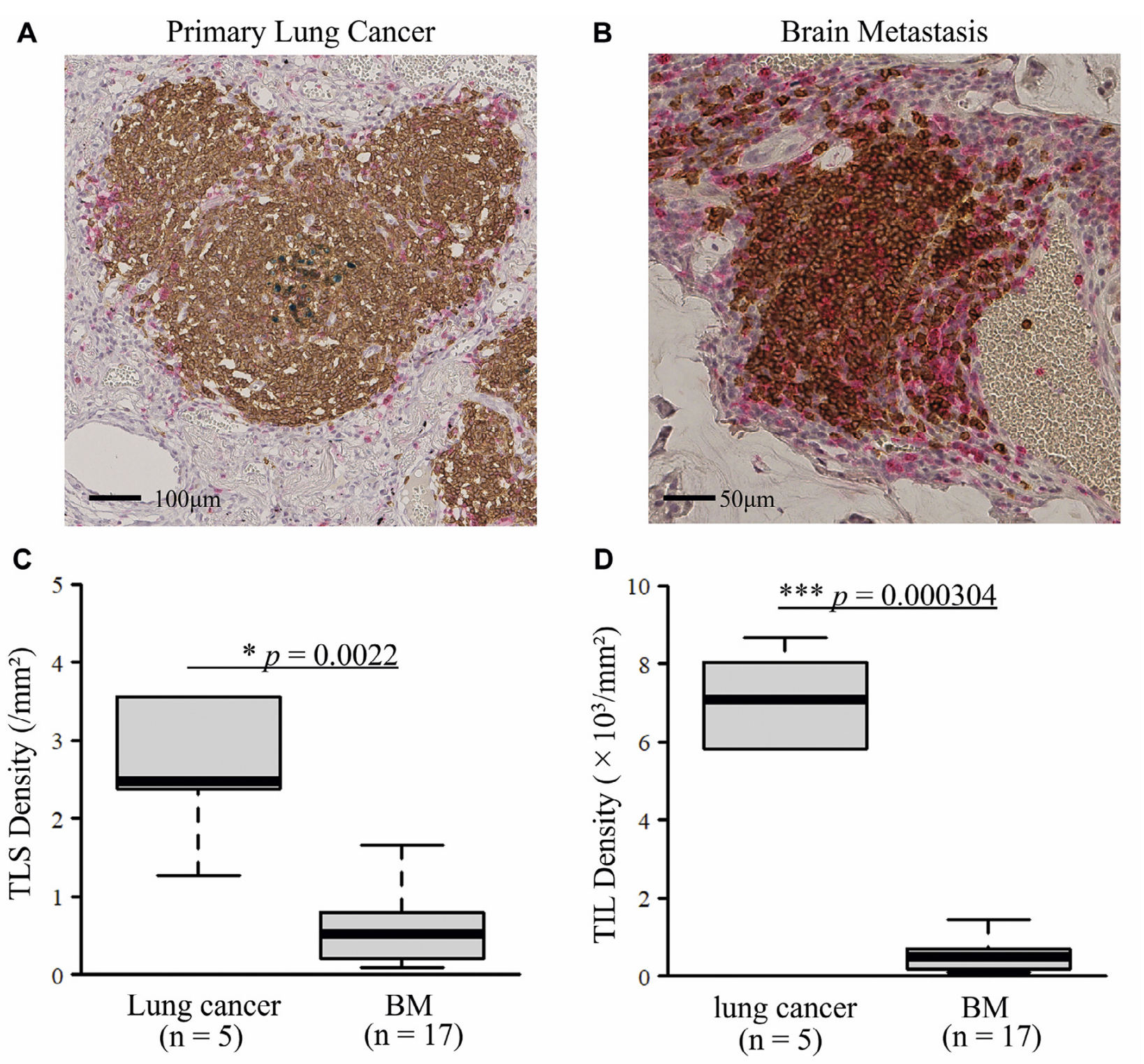
图像分析:
- 图A和图B分别展示了原发性肺癌和脑转移组织中的TLSs。这些图像通过免疫组化染色技术,使用针对CD4(红色)、CD20(棕色)和Bcl-6(绿色)的抗体来标记不同的免疫细胞类型。图A的放大倍数为10倍,比例尺为100微米,显示了原发性肺癌中的一个TLS,其结构较为成熟,具有明显的生发中心。图B的放大倍数为20倍,比例尺为50微米,展示了脑转移组织中的一个TLS,其结构较为松散,缺乏明显的生发中心,表明这是一个未成熟的TLS。
- 图C和图D通过条形图的形式,比较了5个原发性肺癌样本和17个脑转移样本中TLSs和TILs的密度。使用Mann–Whitney U检验来确定p值,以评估两组之间的差异是否具有统计学意义。图中的星号表示显著性水平,其中*表示p<0.05,***表示p<0.001,表明脑转移组织中的TLSs和TILs密度与原发性肺癌组织相比有显著差异。
结论:
- 脑转移组织中的TLSs密度显著低于原发性肺癌组织(图C),这可能反映了脑转移微环境中免疫细胞的募集和组织方式与原发性肿瘤不同。
- 同样,脑转移组织中的TILs密度也显著低于原发性肺癌组织(图D),这可能与脑转移组织中免疫抑制环境有关,导致免疫细胞浸润较少。
- 这些结果表明,脑转移组织中的TLSs和TILs可能在免疫监视和抗肿瘤免疫反应中发挥不同的作用,这可能对开发针对脑转移的免疫治疗策略具有重要意义。
关键问题
问题:文章是如何分析TLSs密度的?
-
免疫组化染色:
- 使用福尔马林固定、石蜡包埋的脑转移肺癌肿瘤样本进行组织切片。
- 切片用于苏木精-伊红(HE)染色和免疫组化(IHC)。
- 组织切片经过二甲苯脱蜡、逐级乙醇稀释复水,并使用热诱导表位修复方法进行抗原修复。
- 使用特定的一抗(如针对CD4、CD20、BCL6和CD8的单克隆抗体)进行免疫染色。
-
图像获取:
- 使用NanoZoomer-SQ全切片成像系统(日本滨松光子学)和20X 0.75 NA目标镜头对染色的组织切片进行数字化扫描。
-
图像分析:
- 使用QuPath(版本0.5.0),一个开源的数字病理学和生物图像分析软件平台,对全切片图像(WSIs)和其他大型生物医学图像进行分析和解释。
- 应用“创建阈值”算法来获取单个肿瘤组织区域。
- 通过手动配置颜色阈值(颜色分解)后,使用QuPath的阳性细胞检测算法识别和定量免疫染色细胞。
-
细胞密度测量:
- 免疫细胞密度以每1平方毫米肿瘤面积内的细胞数来衡量。
- 分析中排除了围绕辐射坏死聚集的淋巴细胞。
-
统计分析:
- 使用EZR软件(版本1.64)进行所有统计分析。
- 通过Mann–Whitney U检验确定两组之间的统计显著性。
- 使用Kaplan-Meier方法和Log-rank测试进行生存时间分析。
通过这些步骤,研究人员能够定量分析TLSs在肺癌脑转移组织中的密度,并将其与临床结果相关联,从而评估TLSs密度作为预后标志物的潜力。
原文地址:https://blog.csdn.net/qq_45404805/article/details/142876252
免责声明:本站文章内容转载自网络资源,如本站内容侵犯了原著者的合法权益,可联系本站删除。更多内容请关注自学内容网(zxcms.com)!
